Glossaire
Histoire
Téléchargements
Les mécanismes initiateurs
Les facteurs influençant l'âge de la puberté
Plusieurs facteurs influencent l'âge de
la puberté:
-certains sont génétiques: similitude entre parents et
enfants, frères et soeurs ou jumeaux monozygotes,
-d'autres sont liés aux conditions socioéconomiques (quand
elles sont bonnes, à travers le monde, la ménarche intervient
vers 12-13 ans), au niveau nutritionnel (la malnutrition retarde la puberté),
au dégré d'activité physique (une certaine activité
physique est bénéfique au développement somatique,
mais la pratique du sport de compétition provoque un retard pubertaire
(ménarche vers 15 ans )) et en rejoignent d'autres, d'ordre constitutionnel:
poids corporel, relation masse grasse/masse maigre.
Les influences d'ordre ethniques ou climatiques sont minimes.
Il existe de nombreux cas de décalage de l'âge pubertaire.
Le retard pubertaire se définit comme l'absence de développement
des caractères sexuels secondaires, à 13 ans chez la fille
et à 14 ans chez le garçon. Quand il n'existe aucune cause
d'anomalie fonctionnelle, on parle de retard pubertaire simple. Il est
beaucoup plus fréquent chez le garçon que chez la fille,
et s'accompagne d'un retard de maturation général (croissance
ralentie et retard de l'âge osseux). L'étiologie correspond
souvent à une dépense énergétique non compensée.
La
puberté précoce se définit comme l'apparition
du développement de caractères sexuels secondaires, avant
8 ans chez la fille et avant 10 ans chez le garçon. Il faut différencier
les pseudo-pubertés précoces (dites aussi périphériques)
qui sont dues à une sécrétion anormale de stéroïdes
suite à une tumeur gonadique ou surrénalienne et qui régressent
dès l'ablation de la tumeur, des pubertés vraies (ou centrales)
dont l'origine peut être tumorale (tumeur hypothalamique secrétant
de l'hCG) ou idiopathiques (sans causes décelables), beaucoup plus
fréquentes chez les filles que chez les garçons.
Les hyperplasies surrénaliennes aboutissent à une accélération
de croissance somatique (l'excès d'androgènes surrénaliens
avance la maturité osseuse) qui entraîne une puberté
précoce. De même, un apport calorique important et un développement
rapide de la masse adipeuse pourraient expliquer la tendance à la
précocité sexuelle observée actuellement dans l'espèce
humaine. Enfin, la présence de certaines hormones dans des produits
cosmétiques a également été invoquée
comme facteur responsable de puberté précoce.
Puberté et sécrétion de GnRH
La puberté commence lors d'une augmentation de la sécrétion de gonadotropines (FSH et LH). Quels sont les facteurs qui contrôlent cette secrétion?
Au cours de la vie, il ya trois périodes dans la sécrétion
des gonadotropines: la mise en fonctionnement des cellules gonadotropes
hypophysaires chez le foetus, la régression de leur activité
au cours de l'enfance et la reprise de leur activité au moment de
la puberté. Comme ces trois phases se rencontrent aussi bien chez
des individus normaux qu'agonadiques (ou chez des mammifères castrés)
on peut conclure que l'absence de sécrétion de gonadotropines
n'est pas dûe à un rétrocontrôle de la part des
stéroides gonadiques.
De plus, il est possible de déclencher, chez le jeune impubère,
par injections répétées de LH ou de GnRH avec une
fréquence convenable, une induction précoce de l'ovulation
et de la menstruation chez la fille ou de la spermatogénèse
chez le graçon. Ces réponses peuvent également être
obtenues par administration de glutamate, neuromédiateur excitateur
induisant des décharges de GnRH. Cependant, à la fin des
traitements, les effets s'estompent et la fonction gonadotrope redevient
silencieuse; la véritable puberté n'a pas été
enclenchée.
Ainsi, l'ensemble des structures hypophysaires et gonadiques est prête
à répondre et c'est bien l'absence de sécrétion
pulsatile de GnRH qui empêche le déclenchement de la puberté.
Dans le cas où l'hypothalamus est déconnecté du
système nerveux central (soit à cause de tumeurs, soit par
des lésions expérimentales de l'hypothalamus chez l'animal),
on observe une puberté précoce. Ceci permet de conclure que
le sytème nerveux central doit exercer un effet inhibiteur sur les
neurones à GnRH de l'hypothalamus.
Il existe des cas de puberté précoce associées
à des tumeurs de la glande pinéale (épiphyse), mais
il n'y a pas d'arguments en faveur d'une influence de la mélatonine
sur les sécrétions gonadotropes. Les retards ou les avances
de la puberté suite à une injection de mélatonine
ou une pinéalectomie, chez l'animal, ne sont que des décalages
dans le déclenchement de la puberté mais n'empêchent
jamais son apparition.
Les molécules impliquées dans le déclenchement pubertaire
L'hypothèse du contrôle de l'entrée en puberté
par un "somatomètre" est basée sur le fait que la puberté
dépend du poids corporel et de la masse adipeuse. Le somatomètre
informerait en permanence le système nerveux central de l'état
de de développement somatique de l'individu.
Plusieurs molécules peuvent rendre compte de cet état,
et jouer le rôle de somatomètre: il s'agit de deux molécules
impliquées dans la croissance, l'hormone de croissance GH et le
facteur IGF-1, et d'une hormone sécrétée par le tissu
adipeux, la leptine.
La leptine présente diverses caractéristiques qui font
d'elle le meilleur candidat.
Sa sécrétion s'élève au début de
la puberté tandis que celle de la GH continue tout au long de la
croissance, jusqu'après la puberté.
Les souris obèses ob/ob (doublement mutée sur le gène
"ob" de la leptine) sont stériles. On peut restaurer leur fonction
gonadotrope en pratiquant des injections de leptine (chez les souris db/db
-le gène "db" code pour le récepteur de la leptine- présentant
le même phénotype, ces injections sont sans effet, par manque
du récepteur à la leptine ). Quand, à l'inverse, la
masse adipeuse est réduite par restriction alimentaire ou excès
d'exercice physique, le niveau de leptine est également bas et la
puberté est retardée. Un injection régulière
de leptine permet de rétablir le processus pubertaire.
Ainsi, la leptine semble jouer un rôle essentiel dans le déclenchement
de la puberté; mais il s'agit seulement d'un rôle permissif
car des injections de leptine à un animal normal (rat, macaque)
n'avancent pas l'âge pubertaire.
Deux autres facteurs contrôlent également le démarrage
de la puberté. Il s'agit du glutamate, neuromédiateur excitateur,
et du GABA, neuromédiateur inhibiteur. Ces deux molécules
semble être directement impliquées dans l'initialisation de
la puberté car le début de la puberté (chez le macaque)
s'accompagne d'une augmentataion du taux de glutamate et une baisse du
taux de GABA dans l'hypothalamus médian, en même temps que
s'élève le contenu en GnRH.
|
D'après Terasawa et al, J. neuroendocr., 1999, 11, 275-282 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
De plus, l'administration d'un analogue du glutamate, le NMDA (N-méthyl-D-aspartate), avance la puberté chez l'animal (ratte, macaque). De même, l'inhibition de la synthèse du GABA dans l'éminance médiane (par blocage de la synthèse d'une enzyme indispensable) entraîne une augmentation de la libération de GnRH.
Afférences nerveuses aux neurones à GnRH
Les neurones à GnRH sont contrôlés par différentes
afférences nerveuses excitatrices ou inhibitrices, directes comme
les neurones à GABA ou à glutamate ou indirectes comme celles
qui mettent en jeu la leptine. La compréhension du mécanisme
d'action de la leptine nécessite la connaissance de la localisation
de ses récepteurs. Ils ont été identifiés sur
les neurones à POMC et NPY. La pro-opio-mélanocortine (POMC)
est un précurseur de diverses molécules (endorphine, ACTH...)
qui jouent, avec le neuropeptide Y (NPY), un rôle fondamental dans
la régulation de l'appétit et de la fonction gonadotrope.
L'élévation de leur taux entraîne une augmentation
du stockage des lipides dans les adipocytes et une élévation
de la leptine. Quand la masse adipeuse est normale, un taux élevé
de leptine entraîne une inhibition de la synthèse de NPY et
une activation des neurones à POMC. Il y a stimulation des neurones
à GnRH.
Si la masse adipeuse est inadéquate et le taux de leptine faible,
le taux de NPY s'élève et inhibe la sécrétion
de GnRH. Ceci explique les retards pubertaires par malnutrition ou encore
les aménorrhées par excès d'exercice physique.
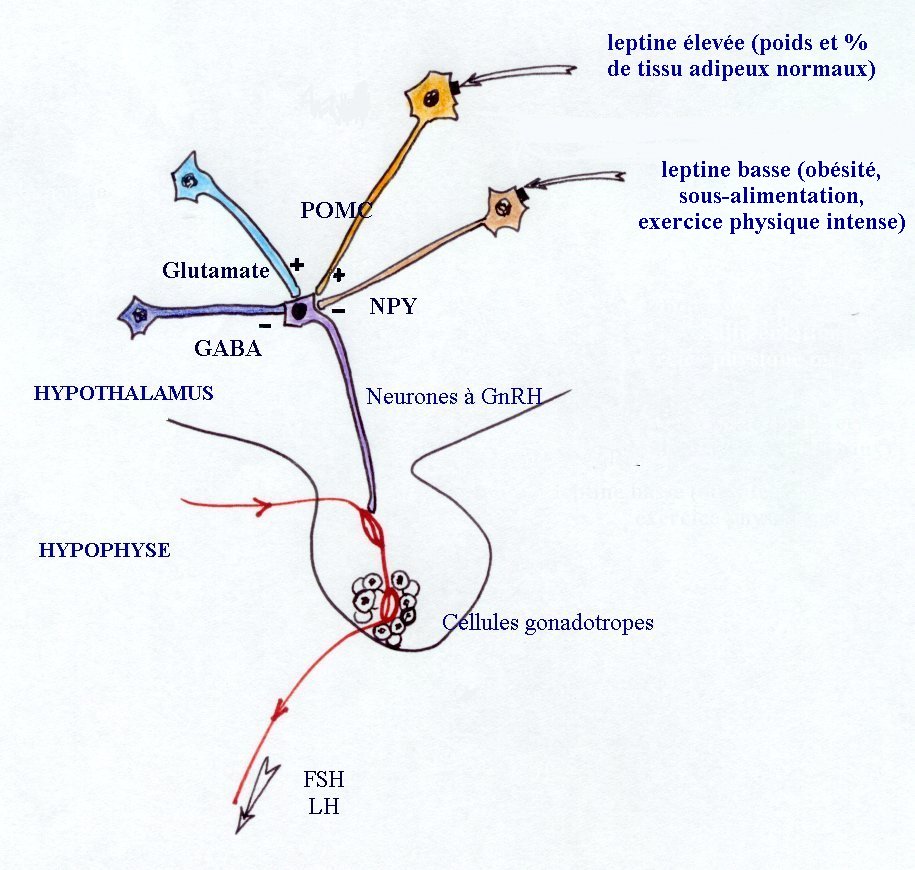 |
| Schéma récapitulant différentes influences
auxquelles sont soumis les neurones à GnRH, et impliquées
dans le démarrage pubertaire.
Les neurones à GnRH (violet) reçoivent des influences
directes des neurones à GABA (en bleu) ou à glutamate (en
ciel) et indirecte, de la leptine, par l'intermédiaire des neurones
à POMC (en jaune) ou à NPY (en marron), sur lesquels elle
se fixe par ses récepteurs (carrés noirs).
|
Pour conclure, en l'état actuel des connaissances, on peut dire que le processus central du démarrage pubertaire est dominé par l'activation des neurones à GnRH (noyau arqué de l'hypothalamus médio-basal) dont la sécrétion est pulsatile. L'activation du générateur de pulses est réprimé jusqu'à la puberté par des facteurs tels que l'insuffisance de développement somatique. Ces facteurs exercent leur influence sur ces neurones par l'intermédiare d'hormone comme la leptine, ou de neuromédiateurs comme le NPY, le glutamate ou le GABA. Mais les mécanismes intimes du déclenchement de la puberté ne sont pas encore totalement connus.