 |
 |
"Ontogenesis of Female-to-Male Sex-Reversal in XX Polled Goats"
E. Pailhoux, B. Vigier, D. Vaiman, N. Servel, S. Chaffaux, E. Cribiu
and C. Cotinot, INRA de Jouy en Josas
in Developmental Dynamics, 224:39-50, 2002
"Contribution of Domestics Animals to the Identification of New
Genes Involved in Sex Determination"
E. Pailhoux, B. Vigier, D. Vaiman, L. Schibler, A. Vaiman, E. Cribiu,
C. Nezer, M. Georges, J. Sundström, L. J. Pelliniemi, M. Fellous and
C. Cotinot, INRA de Jouy en Josas
in Journal of Experimental Zoology, 290:700-708, 2001
"A 11.7-kb deletion triggers intersexuality and polledness in goats"
E. Pailhoux, B.Vigier, S. Chaffaux, N. Servel, S. Taourit, J-P. Furet,
M. Fellous, F. Grosclaude, E. Cribiu, C. Cotinot and D. Vaiman, INRA
de Jouy en Josas
Nature Genetics, 29:453-458, 2001
"Progrès des connaissances génétiques sur l'intersexualité
associée à l'absence de cornes chez la chèvre d'origine
alpine"
J-J. Lauvergne, INRA, station centrale de Jouy en Josas
in Ann. Génét. Sél. anim.,1(4): 403-412, 1969
Des résultats majeurs dans ce domaine ont été obtenus pour les cas d'inversion sexuelle de sujet XY, mais aucun gène autosomal n'a encore été mis en évidence dans les cas d'inversion sexuelle chez des individus XX. C'est pourquoi l'études des animaux domestiques présentant des inversions sexuelles spontanées chez des individus XX est intéressante et contribue à la connaissance des modalités du déterminisme sexuel.
En ce qui concerne le caractère "sans corne" la mutation est dominante (un programme anglais d'éradication des reproducteurs cornus commencé en 1932 ne permit pas d'éliminer ce caractère et il restait encore 40% de chevreaux cornus en 1941).
En ce qui concerne l'intersexualité, elle est, depuis les années 30, considérée comme monofactorielle récessive (mais à l'époque, l'étude du déterminisme génétique du sexe des animaux concernés n'était pas envisageable).
C'est au début des années 40 que l'idée selon laquelle
"absence de cornes et intersexualité" ont un déterminisme
factoriel associé se fait jour. Une enquête révèle
en effet que tous les intersexués sont dépourvus de cornes.
Une explication est proposée: le gène dominant pour l'absence
de cornes serait étroitement lié au gène récessif
d'intersexualité, et son auteur précise (en se basant sur
le fait qu''il existe un déficit considérable de femelles
dans les troupeaux sans cornes) que les intersexués doivent être
des femelles XX.
Puis, en 1944, l'hypothèse s'affine: puisque malgré les
générations successives qui naissent on ne peut pas séparer
les souches présentant seulement de l'intersexualité de souches
sans cornes, les deux caractères doivent être gouvernés
par un seul et même gène, pléiotropique.
Le gène p ("polled") présente donc deux allèles:
p récessif est l'allèle sauvage qui gouverne la présence
de cornes et P dominant est l'allèle muté qui gouverne l'absence
de cornes. Les individus issus d'un croisement entre deux parents hétérozygotes
(p/P) sont repartis comme suit:
1/4 (p/p) : mâles et femelles cornus (et normalement sexués)
1/2 (p/P) : mâles et femelles sans cornes (et normalement sexués)
1/4 (P/P) : mâles sans cornes (et non intersexués), femelles
sans cornes (et intersexuées)
La mutation du gène p, aujourd'hui identifiée et nommée PIS(-) (Polled Intersex Syndrome) à la place de P, a donc, selon son état, deux types de conséquences:
-à l'état hétérozygote PIS (-/+) (équivalent p/P) et homozygote PIS (-/-) (équivalent P/P), elle entraîne l'absence des cornes dans les deux sexes; c'est une mutation dominante
-à l'état homozygote, PIS(-/-) (équivalent P/P), elle entraîne, en plus de l'absence des cornes, chez des animaux de sexe chromosomique femelle XX uniquement, l'apparition d'un phénotype mâle et des ambiguités des organes génitaux externes (dans le cas d'une entière masculinisation, ces animaux sont considérés comme mâles ce qui explique le décalage de sex-ratio observé en faveur des mâles); c'est une mutation récessive qui est donc responsable d'une inversion sexuelle 'femelle vers mâle'.
Un autre effet de cette mutation est à noter chez certains mâles. Parmi les mâles stériles on trouve deux types d'individus: des animaux qui présentent des granuloma au niveau de l'épididyme avec blocage du transit des spermatozoides (mais qui peuvent être fertiles si l'atteinte est unilatérale) et qui ont une stature de mâle, et d'autres, qui présentent une hypoplasie des testicules (sont toujours stériles) et présentent une stature de femelle. Les premiers sont des mâles chez lesquelles la mutation homozygote PIS s'exprime par cette anomalie épididymaire alors que les seconds sont des femelles inversées.
D'autre part, cette mutation entraîne, chez certains animaux,
un accroissement de la fertilité.
Différents phénotypes des chèvres selon le sexe chromosomique et le génotype PIS
|
|
|
||
|
|
|
|
|
|
|
|
Mâles mottes fertiles plus prolifiques que les mâles
PIS(+/+)
|
Mâles mottes fertiles plus prolifiques que les mâles
PIS(+/+) et (+/-)
Mâles mottes atteints d'obstruction de l'épididyme: -partiellement ( fertiles) -d'une manière généralisée (stériles) |
|
|
|
Femelles mottes fertiles plus prolifiques que les femelles PIS(+/+) | Animaux mottes tous stériles, inversés sexuels
-1/2 mâles XX sans ambiguité -1/2 mâles XX avec ambiguité génitales externes |
Les animaux de l'élevage de Jouy-en-Josas
La mutation polled, "sans corne", se rencontre dans différentes
races, saanen et chamoisé.
Ces animaux sont les reproducteurs: animaux 'témoins' ou hétérozygotes
pour la mutation PIS.

Bouc de race saanen, témoin non muté |

Bouc de race chamoisé, hétérozygote pour la mutation PIS |

Chèvre de race chamoisé, témoin non mutée |

Chèvre de race chamoisé, hétérozygote pour la mutation PIS |
Ensuite, entre 56 et 70 jpc, le nombre de cellules germinales diminue
très vite dans les cordons séminifères et il n'en
subsiste pratiquement plus à la naissance. A ce moment, le degré
de masculinisation des organes génitaux externes est variable selon
les individus:
-soit de type mâle, pour les individus possédant des testicules
(environ 50% des cas)
-soit ambigu: clitoris proéminent et allongement de la distance
ano-génitale, pour les individus ayant des gonades hermaphrodites.
Dans tous les cas, l'absence de cellules germinales rend ces individus stériles.
Si la masculinisation extrême observée chez les foetus
de chèvres XX PIS(-/-) est plus forte que celle observée
chez les femelles XX inversées dans d'autres espèces comme
le chien ou le porc, cela peut provenir de la précocité de
cette inversion, qui n'est ici décalée que de 4 jours par
rapport au décours temporel normal de la différenciation
de la gonade mâle XY.
Histologie des gonades (à 56jpc), de divers types d'individus témoins ou concernés par la mutation PIS
(chaque photographie a une hauteur correspondant à 50 micromètres environ)
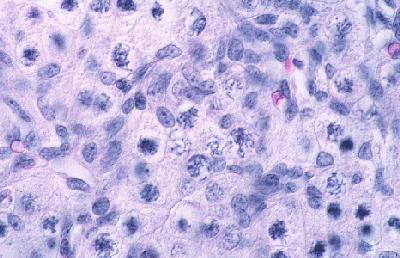
Gonade de foetus de chèvre XX, témoin non muté.
|
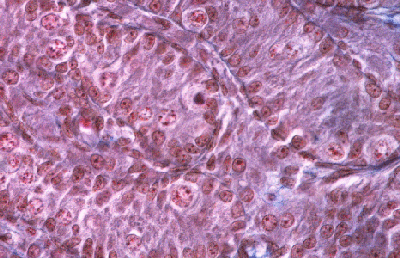
Gonade de foetus de chèvre XY, témoin non muté.
|
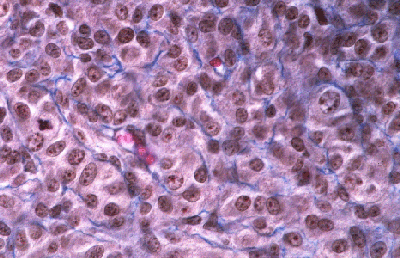
Gonade de foetus de chèvre XX, PIS (-/-), type ambigu.
|
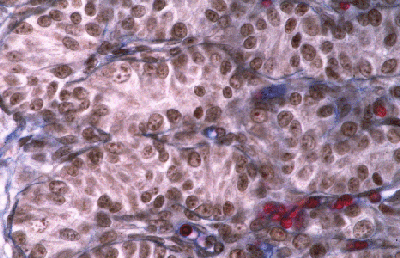
Gonade de foetus de chèvre XX, PIS (-/-), type masculinisé.
|
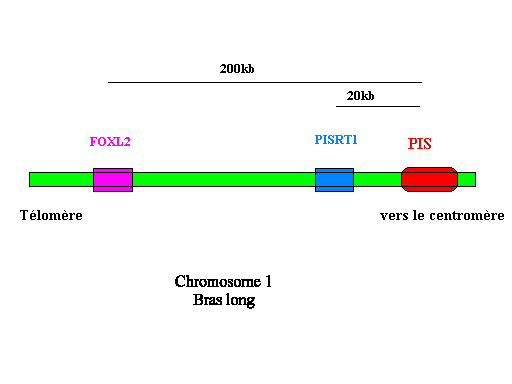
La région humaine, homologue du locus PIS, a été localisée sur le chromosome 3 (Ch3q23). Des mutations invalidant le facteur de transcription FOXL2 ont pour conséquences médicale le syndrome BPES, qui conduit à une malformation des paupières associée à une stérilité féminine par déficience ovarienne primaire.
Plusieurs expériences montrent que la mutation PIS exerce une
régulation à distance de la transcription de PISRT1 et de
FOXL2.
Pour FOXL2, la transcription est également sexuellement dimorphique; là aussi, elle est plus élevée dans la gonade femelle normale que la gonade mâle normale. Chez les femelles sexuellement inversées, les gonades foetales présentent un taux d'expression de FOXL2 extrêmement bas dès 36 jpc.
La délétion PIS affecte donc l'expression des gènes PISRT1 et FOXL2 dans les gonades. Elle renferme donc une région régulatrice.
Chez l'homme, FOXL2 est un gène dont l'expression peut être modifiée par une translocation située 100 kb en amont , il existe donc également chez l'homme une région régulatrice de ce gène, qui reste encore à découvrir.
Chez la chèvre, l'étude des profils d'expression des gènes PISRT1 et FOXL2 a été mise en parallèle avec celle de SOX9. A 36 jpc, ches les XX-inversés, l'expression de PISRT1 est toujours élevée, comme chez les femelles, et celle de FOXL2 est déjà effondrée. A 40 jpc, celle de PISRT1 s'effondre à son tour. C'est au cours de l'effondrement de l'expression de PISRT1 que celle de SOX9 commence à s'élèver dans les gonades de femelles inversées, adoptant un niveau similaire à une gonade mâle. C'est sur cette constatation que repose l'hypothèse que FOXL2 est un gène "ovarien" , un ODF (Ovarian Determing Factor), et PISRT1 un gène de contrôle "mâle", de type antitestis, empêchant normalement la différenciation mâle chez une femelle XX (voir le C. Corrélation avec le modèle du gène Z).
Profils d'expression de divers gènes impliqués dans la différenciation de la gonade en ovaire ou testicule,
chez des animaux témoins et des XX PIS(-/-) indiqués par leur numéro (250, 252...)
 |
| Ces RT-PCR (Reverse Transcriptase-Polymerase Chain recation),
réalisées sur des gonades prélevées à
différents moments du développement, montrent que les gonades
inversés sexuellement (numéros) expriment les gènes
SOX9 et AMH caractéristiques des gonades mâles (M) et n'expriment
pas le gène CYP19 (de l'aromatase) caractéristique des gonades
femelles (F).
En ce qui concerne le gène de la deshydrogénase (3bêta-HSD) impliquée dans la synthèse des stéroides, les gonades inversées l'expriment plus tôt que les gonades femelles, adoptant ainsi un profil d'expression de type mâle. |
Une sur-expression de gènes mâles comme SOX9 (gène très conservé au cours de l'évolution) a été observée du 36ème au 40ème jpc chez les XX-inversés au lieu de 32 à 35 chez les mâles normaux. Le gène SOX9 qui intervient très tot dans la différenciation mâle de la gonade, est capable d'induire l'expression de l'AMH dans les cellules de Sertoli. Après la sur-expression de SOX9 on observe chez les foetus XX-(PIS-/-) une surexpresion de l'AMH à partir de 40 jpc, entrainant une régression des canaux de Müller et une inhibition secondaire de l'expression de l'aromatase (postérieure cette fois à la baisse de l'expression observée précocément).
C. Corrélation avec le modèle du gène Z
Depuis 1993, Mc Elreavey et ses collaborateurs ont postulé l'existence
d'un gène (nommé Z à l'époque) dont le rôle
serait d'orienter la différenciation de la gonade dans le sens femelle
en inactivant un gène de détermination du sexe mâle.
L'inactivation de ce gène Z, serait donc de mise chez tous les
mâles normaux et apparaitrait de façon inoppinée chez
certaines femelles par mutation de ce gène, entrainant alors, même
en absence de SRY - et c'est là que se trouve l'intérêt
de ce modèle - une différenciation de la gonade en testicule
et une inversion sexuelle.
Les observations réalisées dans le cas des chèvres mottes sont cohérentes avec un modèle dans lequel PISRT1 inhibe SOX9, jouant le rôle d'un gène antitestis, comme proposé dans le modèle du gène Z
Le gène FOXL2 est impliqué dans le maintien des ovaires, peut-être par son action précoce sur la folliculogénèse, et pourrait constituer un ODF.
La proximité de ces deux gènes du même élément régulateur autorise une régulation concommitante de ces deux gènes, par la séquence régulatrice PIS, qui serait l'équivalent de Z.
Ainsi, selon cette hypothèse, cette région du chromosome
1 contient un élément régulateur, un antitestis et
un gène de détermination ovarienne. Chez la femelle l'élément
régulateur PIS (gène Z) inhibe le sexe mâle par l'activation
d'un antitestis et stimulation d'un ODF. Chez le mâle cette région
régulatrice PIS doit être inhibée et c'est le gène
SRY qui, potentiellement, est le meilleur candidat à cette fonction.
SCHEMA BILAN de l'hypothèse actuelle de l'implication de PISRT1 et FOXL2 dans le déterminisme du sexe
(les gènes qui s'expriment sont en couleur)
 |
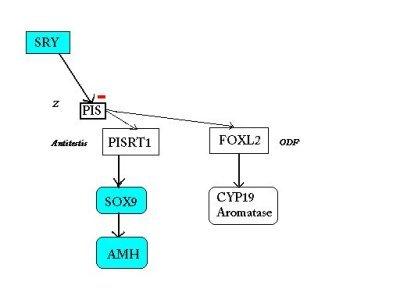 |
| Chez la femelle: la région régulatrice
PIS entraîne
- l'expression de PISRT1 qui, par son ARNm, inhibe SOX9 et la cascade de type mâle, - et l'expression de FOXL2 qui déclenche à son tour celle de CYP19 et la synthèse de l'aromatase( responsable de la production d'oestrogènes). |
Chez le mâle: SRY inhibe la région
régulatrice PIS (hypothétique gène Z, orientant la
détermination vers le sexe femelle).
Ainsi PISRT1 n'est pas lu et SOX9 n'est donc pas inhibé, il s'exprime et déclenche la cascade mâle tandis que l'absence d'expression de FOXL2 empêche la production d'aromatase. |
Comment expliquer la variabilité des phénotypes observés chez les individus de génotype PIS(-/-)?
Dans de nombreux cas d'intersexualité , on rencontre, pour des génotypes similaires, des phénotypes variés. Le processus de détermination du sexe met en jeu de nombreux gènes, intervenant par un subtil dosage de leur expression, comme WT1, SF1, SOX9 ou encore DAX1. Les plus petites modifications de ce dosage peuvent affecter la différenciation de la gonade et être à l'origine d'une masculinisation plus ou moins prononcée.
Pourquoi les cellules germinales dégénèrent-elles dans les gonades des individus XX PIS(-/-) inversés sexuellement ?
La dégénérescence des cellules germinales de la
gonade XX PIS(-/-) ne se réalise pas à un moment précis
mais débute dès 56jpc (moment où ces cellules devraient
entrer en méiose chez une femelle XX) et continue jusqu'à
la naissance. Deux explications peuvent être avancées.
- D'une part, cette dégénérescence peut provenir
d'une anomalie du dosage des gènes portés par X. En effet,
les cellules germinales XX subissent une inactivation de l'un de leur chromosome
X au cours de leur migration, à partir de l'allantoide, et réactivent
le X inativé lorsqu'elles atteignent la crête génitale
du mésonéphros. Dans une gonade XX-PIS(-/-), se différenciant
en testicule, ces cellules n'entrent pas en meiose, et réactivent
le X inactivé au même moment que dans une gonade XX. Il est
possible que l'expression de deux chromosomes X soit incompatible avec
le développement de cellules germinales de type mâle.
- D'autre part, il a été montré que la présence
d'AMH dans une gonade XX au moment où les cellules germinales devraient
entrer en méiose est responsable de leur dégénérescence
(voir la synthèse sur le free-martin).
Ici la mutation PIS(-/-) entraine une expression de SOX9 et donc une production
d'AMH par les cellules précurseurs de sertoli qui se différencient
dans les cordons séminifères de cette gonade inversée.
Ce modèle caprin pourrait avoir un autre intérêt
en génétique humaine. Le phénotype particulier (absence
de
cornes et intersexualité) décrit chez les chèvres
a pour origine une anomalie localisée dans une rgion du génome
caprin possédant un homologue dans le génome humain. Cette
région du génome humain est impliquée dans une maladie
rare, le Blepharophymosis-Ptosis-Epicanthus inversus Syndrome (BPES). Ce
dernier associe, chez les femmes, une malformation des paupières
et une stérilité ou une ménopause précoce (anomalie
ovarienne: présence de très peu de follicules). Dans cette
maladie humaine, c'est le fonctionnement du gène FOXL2 qui est perturbé.
Le plus souvent il s'agit de mutations "classiques" du gène, mais
dans certains cas, non encore élucidés, c'est une perturbation
"à distance" du gène FOXL2 qui se produit, rappelant ainsi
le mécanisme observé chez les chèvres (une séquence
régulatrice, homologue de celle décrite chez la chèvre,
reste encore à découvrir dans cette région du génome
humain).
•un clonage: le noyau d'une cellule de chèvre XX-PIS(-/-) a été transféré dans un ovocyte de chèvre normale (clonage somatique à partir de fibroblastes d'un foetus XX PIS(-/-), obtenu par croisement classique entre un bouc et une chèvre hétérozygotes PIS(-/+)). Le blastocyste qui en a résulté a été implanté dans l'utérus d'une mère porteuse et a donné un chevreau XX-intersexué. Cette expérience a servi de preuve de faisabilité technique et montre que l'intersexualité observée est entièrement sous contrôle génétique.
•une transgénèse: la technique précédente a été reprise avec pour seule modification l'introduction par transgénèse du fragment d'ADN contenant le gène PISRT1 et son promoteur dans le noyau initialement transféré. Ce gène devrait rétablir l'effet dû à la délétion de la région PIS , c'est à dire inhiber l'expression de SOX9 et entraîner la différenciation des chevreaux dans le sens femelle....résultats en attente!