|
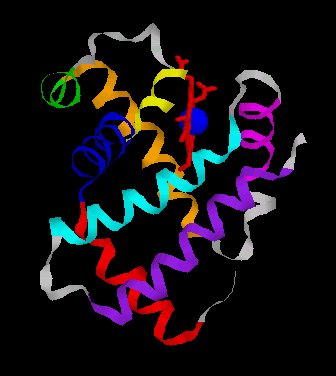
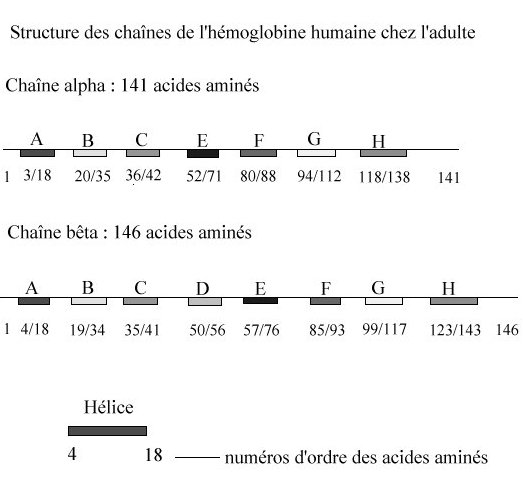
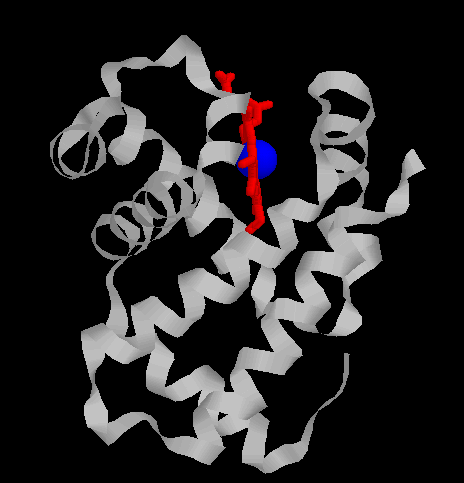
Les globines constituent une famille de protéines largement répandues. Elles sont toutes impliquées dans le transport ou le stockage du dioxygène. L'hémoglobine HBA (hémoglobine adulte normale), dissoute dans le cytosol aqueux des érythrocytes en une solution très concentrée, assure le transport du dioxygène des poumons vers les tissus. Un globule rouge humain de 7 mm, contient 280 millions de molécules d’hémoglobine. Chaque molécule d’hémoglobine est un tétramère formé par l’association de quatre chaînes polypeptidiques identiques deux à deux : deux chaînes alpha (ou globines alpha) composées chacune de 141 acides aminés et deux chaînes bêta (ou globines bêta) de 146 acides aminés. Chacune des chaînes adopte une conformation spatiale lui donnant une forme globuleuse et ménageant une « poche » superficielle dans laquelle se trouve logé le hème. La cohérence du tétramère (structure quaternaire de l’hémoglobine a2-b2) résulte de liaisons dues aux chaînes latérales hydrophobes des acides aminés situés à la périphérie de chaque globine. 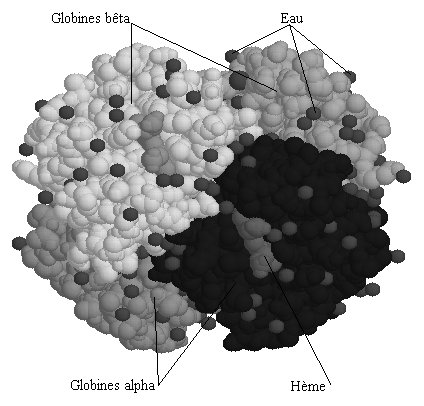 Une chaîne polypeptidique alpha ou bêta présente
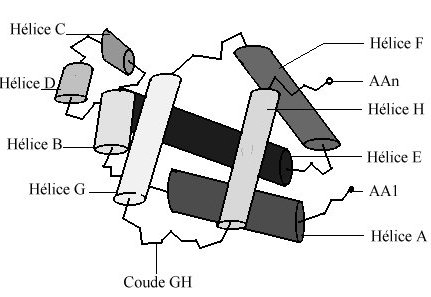
sept ou huit secteurs en forme d’hélice droite reliés par
des segments comportant parfois des coudes.
Bien que les chaînes alpha et bêta aient des séquences
différentes, elles présentent des structures tertiaires assez
similaires.
Quatre
sous-unités s'associent dans une symétrie tétraédrale
pour former la molécule d'hémoglobine (fichier 3D de
50 Ko - molécule partielle restreinte à ses seuls carbones
alpha), structure globulaire de 65 x 50 x 55 Å. En fait, le tétramère
résulte de l'association de deux dimères fonctionnels : a1
b1
et a2 b2. Dans la
structure tétramérique, les dimères sont disposés
de façon à ce que la sous-unité a1
soit au contact de la sous-unité b2 et
a2
de b1.
Trois zones de contact sont donc à distinguer :
C'est au niveau de cette zone que s'effectuent les mouvements de glissement et de rotation qui accompagnent la modification de conformation de l'hémoglobine lors de l'oxygénation. Les résidus en contact diffèrent pour chacune des configurations. Chez tous les vertébrés, l'hémoglobine est un tétramère dont les sous-unités sont identiques deux à deux et se distinguent en type alpha et béta. La structure spatiale de ces sous-unités a été remarquablement conservée (2 fichiers 3D de 14 Ko chacun - molécules restreintes aux seuls carbones alpha) depuis l'apparition de la molécule ancestrale qui remonte sans doute à quelques 600 à 700 millions d'années. Une duplication ultérieure du gène hémoglobinique a conduit aux deux types de chaînes a et b et à l'apparition de l'hétéro-tétramère. A partir de ce stade, des duplications successives, l'accumulation de mutations et la pression sélective ont conduit à des molécules parfaitement adaptées aux diverses conditions d'environnement. Les études par diffraction de rayons X ont permis dès 1960 de connaître la structure spatiale de la molécule d'hémoglobine avec une résolution de 5,5 Å. L'interprétation de ces résultats a grandement bénéficié de ceux obtenus à plus forte résolution pour la myoglobine. Aujourd'hui, la structure spatiale de l'hémoglobine est connue avec un degré de résolution de 1,7 Å, ce qui donne une excellente définition de la position de chaque atome. La comparaison des structures primaires des hémoglobines monomériques (ou des sous-unités), depuis les espèces animales les plus primitives jusqu'à l'homme, est assez décevante : les homologies entre espèces éloignées sont faibles, et à priori rien ne laisserait même penser à une parenté structurale. Au contraire, la comparaison des structures spatiales montre une géométrie remarquablement conservée. Toutes les myoglobines et sous-unités d'hémoglobines,
qu'elles proviennent des leghémoglobines des rhizomes (du règne
végétal) ou des hémoglobines (de la série animale)
partagent une même structure spatiale. Chaque
globine est caractérisée par la présence de huit segments
hélicoïdaux , repliés de façon à ménager
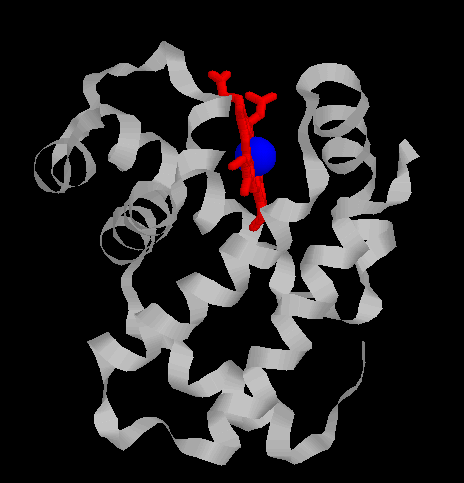
une cavité hydrophobe dans laquelle une molécule d'hème
est enfouie (attention fichier de 78 Ko - molécule beta complète).
La cavité en forme de V, dans laquelle
la molécule d'hème est logée, est limitée par
les hélices B, C, E, F, G, H et par le segment CD.
L’oxygénation de l’hémoglobine provoque une modification
de sa conformation tridimensionnelle : la molécule d’oxyhémoglobine
est un peu plus compacte que celle de la désoxyhémoglobine
; les hèmes subissent des modifications spatiales lors de la fixation
du dioxygène, l’atome de fer se déplace.
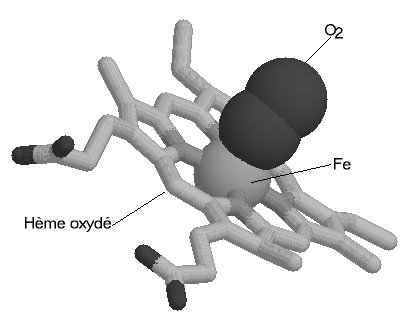
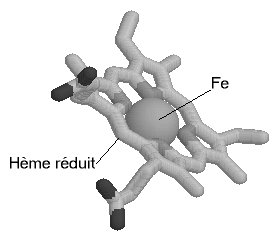
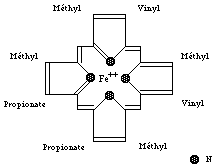
Une molécule d'hème (fichier de 14 Ko - molécule restreinte aux seuls carbones alpha) est liée à chacune des sous-unités. Il s'agit d'une molécule plane, ou légérement bombée, selon le groupe lié à sa sixième valence de coordinence. Sa structure est connue depuis le début du siècle : elle est constituée par une protoporphyrine ayant à son centre un atome de fer. La protoporphyrine est formée de quatre cycles pyrroliques unis par l'intermédiaire de ponts méthénylés (-CH=) et substitués par des groupes méthyl, propionate et vinyl dont la disposition est caractéristique du type IX . Que la molécule d'hémoglobine soit oxygénée (oxyhémoglobine) ou désoxygénée (désoxyhémoglobine), le fer reste sous forme réduite (Fe++) (2 fichiers de 14 Ko chacun - molécules restreintes aux seuls carbones alpha). Dans l'oxyhémoglobine, l'atome de fer présente six liaisons de coordinence : quatre interviennent dans la structure de l'hème, la cinquième amarre l'hème à la globine au niveau de l'histidine F8 (histidine proximale) et la sixième fixe une petite molécule tel l'oxygène, appelé "ligand". Ce ligand est en rapport avec l'histidine E7 (histidine distale). Dans la désoxyhémoglobine, où aucun ligand n'occupe la face distale de l'hème, le fer est pentacoordonné. Par suite d'une distribution différente des électrons dans les couches périphériques, le volume de cet atome augmente. Ces changements de taille sont à la base même des mécanismes de modification de configuration de la structure protéique accompagnant la fixation d'oxygène. Le rôle de la protéine entourant l'hème peut très schématiquement se résumer à :
Lors de la transition de la configuration désoxygénée vers la configuration oxygénée, le 2,3-DPG est expulsé de la cavité centrale.
|